テクノロジー
技術レポート:アーカイブ
Category:ライフサイエンス
がんゲノムデータベースの紹介
本邦では2015年からがん遺伝子検査が一般医療に供され始めることで、がんゲノム医療(「プレシジョン・メディシン」や「個別化医療」などとも言われる)が始まった。三菱スペース・ソフトウエア株式会社(MSS)でも2016年4月からがん遺伝子検査のデータ解析業務にてがんゲノム医療分野に参入し、さらに翌2017年からPleSSision検査としてがん遺伝子パネル検査を提供してきた。さらに、2019年度から保険診療にてがん遺伝子検査が認可され、現在では全国のがんゲノム医療中核拠点病院等にてがんゲノム医療を受診できる体制が整えられた。このようにして、本邦にてがんゲノム医療がスタートしてから5年が経過しゲノムデータを含む臨床データの蓄積が進んだ。がんゲノム医療から蓄積された臨床データは、従来の臨床研究や治験から得られたデータベースに比べて、診療全般に関する情報が含まれており、Reverse Translational Researchと呼ばれるアプローチで新たな創薬や生命保険サービスなどの研究開発が進められている。本稿では、当社のがんゲノムデータベースについて紹介する。
参考情報:
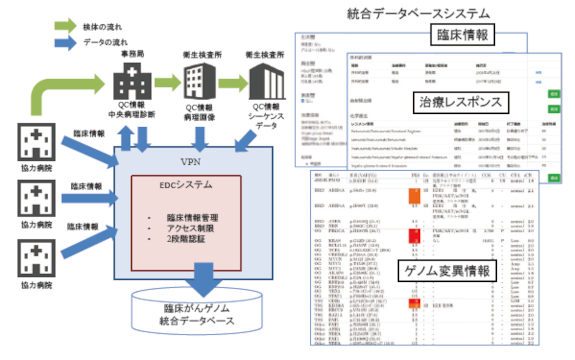
1 MSS 技報・Vol.32 がんゲノムデータベースの紹介 Introduction of the MSS clinical cancer genomic database 谷嶋 成樹*Shigeki Tanishima 本邦では2015 年からがん遺伝子検査が一般医療に供され始めることで、がんゲノム医療(「プレシジョン・メディシン」や「個別化医療」などとも言われる)が始まった。三菱スペース・ソフトウエア株式会社(MSS)でも2016 年4月からがん遺伝子検査のデータ解析業務にてがんゲノム医療分野に参入し、さらに翌2017 年からPleSSision 検査⑴⑵としてがん遺伝子パネル検査を提供してきた。さらに、2019 年度から保険診療にてがん遺伝子検査が認可され、現在では全国のがんゲノム医療中核拠点病院等にてがんゲノム医療を受診できる体制が整えられた⑶。このようにして、本邦にてがんゲノム医療がスタートしてから5年が経過しゲノムデータを含む臨床データの蓄積が進んだ。がんゲノム医療から蓄積された臨床データは、従来の臨床研究や治験から得られたデータベースに比べて、診療全般に関する情報が含まれており、Reverse Translational Research(*1と呼ばれるアプローチで新たな創薬や生命保険サービスなどの研究開発が進められている⑷⑸。本稿では、当社のがんゲノムデータベースについて紹介する。 In Japan, fi ve years have passed since the full‒scale start of cancer genomic medicine( alsocalled “Precision Medicine” or “Personalized Medicine”) and aggregation of clinical cancer genomicdata. Compared to the databases obtained from conventional clinical research and clinicaltrials, the clinical cancer genomic data contains information on general medical care. Andresearch and development of new drug discovery and life insurance special contract service arecarried out using an approach called “Reverse Translational Research” of the cancer genomicdatabase. We introduce our clinical cancer genomic database. *関西事業部 バイオメディカルインフォマティクス開発部 1.がんゲノム医療早わかり 1.1 従来のがん治療はRCT による治療エビデンスで決められるがん治療では、製薬企業治験や医師主導治験により従来との優位性が統計的に証明された治療法が提供される。一般的に、治験においてはdbRCT(double–blindRandomized Controlled Trial:二重盲検ランダム化比較試験)(*2の結果が最高の治療エビデンスとされ、日本の国民皆保険システムではdbRCT で認められた治療法が承認されることが多い。これは、年齢、性別を始めとする治療に影響を与えると考えられる背景事項に関して均質な患者二群を設定し、処方する医薬品だけを変え、治療成績の差を統計的に評価することで、新しい治療法が優れていることを証明する(図1a.)。この時、対照群として無治療(偽薬)や従来の医薬品が用いられる。優越性が証明されたものだけ保険診療の標準治療として全国統一的に供されるため、国民全体レベルでは確実に治療による利益がもたらされる。年齢・性別など分布を揃えたがん患者(背景の条件は統計的に偏りが無いという前提)発がんの原因となるドライバー遺伝子変異は人それぞれ異なる実は・・・○ ×統計的に治療成績が良い薬品を選ぶがん遺伝子パネル検査ドライバー遺伝子に応じた分子標的薬を処方がん組織遺伝子変異に対応した医薬品を選ぶa. 標準治療b.がんゲノム医療薬A 薬B背景は同じ結果だけ違う図1 がんゲノム医療と従来型の標準治療はエビデンスの考え方が異なる2 MSS 技報・Vol.321.2 がんゲノム医療ではがんドライバー遺伝子変異に分子標的薬をマッチさせる2010 年以降、ゲノムDNA を低コストで読み取ることができる次世代シーケンサーが普及したことでがん組織のゲノム変異解析による研究が進展した。その結果から、同じ臨床診断・病理組織診断においてもがん組織のゲノム変異の分類が進み、がん化に強く関連するドライバー遺伝子変異により細分化されることが判明した。これは、前述のdbRCT 試験のようなRCT(Randomized Controlled Trial)試験において二群に分けられたグループの中に、ドライバー遺伝子が異なる様々なサブグループが存在することを意味している(図1b.)。dbRCT に基づく標準治療では、集団として評価した場合は確実に治療効果が見られるものの、治療の奏効率自体はそれほど高くはない(20 % ~ 30 % と言われる)。一般的にがんの分子標的薬は設計されたドライバー遺伝子に一致しなければ奏効しないため、従来のがん種を中心とした患者分類では薬剤とのミスマッチがかなりの確率で生じていると考えられる。がんゲノム医療ではがん種に関わらず個人レベルでドライバー遺伝子変異を判定するため、症例ごとに薬剤選択の最適化が可能になる。そのため、これまでに比べて奏効可能性の高い分子標的薬の処方や場合によっては他がん種で承認されている分子標的薬の適応外使用が可能になり⑹(図2)、治療効果の向上が期待できる。対象となるがん組織の状態が図3に示すような免疫システムに強く認識されている状態のHot Tumor が望ましいと言われている⑺。「がん」は体細胞のゲノム変異により異常な増殖能を獲得した異常細胞の塊である。通常、がんにはゲノム変異が多数生じている、つまり、がん抗原性が高いことから自身の免疫システムからは「異物」と認識され攻撃の対象となる。しかし、体内にがん組織が形成される過程において自身の免疫システムから逃れる仕組みが働き、自身の免疫システムに認識されつつも攻撃を逃れているHot Tumor と呼ばれる状態になっている場合がある。Hot Tumor はがん抗原性が高い、すなわち、がん化によって生じたゲノム変異数(TMB:Tumor MutationBurden)(*3やマイクロサテライト不安定性(MSI:Microsatellite Instability)(*4が高いという特徴があり、さらに、免疫システムの攻撃役であるT 細胞ががん組織に深く浸潤している状態がみられる。Hot Tumor の因子の一部であるTMB やMSI はがんゲノム検査により診断可能であり、既に実用に供されている。しかし、TMB やMSI が低いにもかかわらず免疫チェックポイント阻害剤が奏効する症例が少なからずある。これらには浸潤したT細胞側のゲノム変異や遺伝子発現の変化が関わっていると考えられており、現在世界中で研究が進められている。3.臨床がんゲノムデータベースこれまで、蓄積されてきたがんゲノムデータベースは、主にRCT 試験の際に解析された結果を蓄積したものである。よって、図4a.に示すとおり、あらかじめ決められた患者二群に関するデータの蓄積であることが多く、一般診療の症例とは必ずしも患者背景が一致せず、患者層別化においては部分的な効果しか得られなかった。がんのドライバー遺伝子変異が潜んでいる場所核(ゲノムDNA)核分裂増殖シグナル増殖因子受容体がん細胞分子標的薬の作用する場所核に作用する「殺細胞性抗がん剤」は、DNAコピーを阻害する。よって正常細胞にも強く働くため副作用が強いがんドライバーとして働いている場所に「当たれば」非常によく効くEGFR阻害薬HER2阻害薬MEK阻害薬・・・当たらなければ・・・全く効かない副作用だけが出る正確な変異解釈と推奨薬剤がキモ図2 分子標的薬によるがん治療がん抗原性は高い“Hot Tumor”● ● ● ● ●● ● ● ●● ● ● ● ●● ● ● ● ● ●● ● ● ●●● ● ●● ● ●● ●●● ●●自然免疫獲得免疫排除がんの増殖● ● ●● ●● ●●●● ●●● ●●● ●●●● ●●●●●● ● ●免疫により選択されたがん細胞(自己もどきで認識が弱い)●● ●T細胞免疫応答を抑制したがん細胞(免疫が止められている)正常細胞ゲノム変異正常細胞がん抗原性は低い“Cold Tumor” ●●●排除【従来型】がん抗原の認識を高める治療【免疫チェックポイント阻害剤】免疫のブレーキをはずす治療図3 免疫チェックポイント阻害剤の考え方2.免疫チェックポイント阻害剤の処方もがんゲノム医療による最適化が望まれるがんの治療法の1つである免疫療法、中でも免疫チェックポイント阻害剤による治療は薬物による完治を望めるものとして非常に期待されている治療法である。免疫チェックポイント阻害剤が奏効する条件は、治療3 MSS 技報・Vol.32近年、がんゲノム医療が診療に取り入れられてきており、そこから得られるデータは多様ながん種、多様な治療経過を含むことから(図4b.)、様々ながんゲノム変異と診断・治療結果の関連性を抽出することが可能になってきた。4.当社のがんゲノムデータベース前述のとおり、当社は2016年4月からがんゲノム医療市場に参入し、さらに2017 年からがんゲノム検査PleSSisionの提供などにより臨床がんゲノムデータの蓄積に努力してきた(収録件数は2021 年10 月時点で約8,000症例)。現在、当社のデータベースは、図5に示すとおりEDC(Electric Data Capture)(*5システムによって研究協力病院からオンラインでデータ登録が可能な構成になっており、検体に関しては中央病理診断にて統一的な病理評価がなされたのちにがんゲノムデータと統合されて格納される。これにより検体の組織型や腫瘍含有率などゲノム解析結果の解釈に必要な診断情報の精度が保証される。加えて、当社のがんゲノムデータベースは次のような特徴を備えている。(1) モデル化された臨床データ診断時に確定する基本的なデータ項目として、がん種(原発巣)は治療エビデンスの検索に最適化され統制された37 種類に分類されている。その他、ステージ、家族歴、喫煙歴、悪性腫瘍に関する既往歴が記録される。確定診断後の治療経過に関しては、治療内容を示すレジメンとRECIST ガイドライン⑻に準拠した治療効果をイベントとして記録される。また、患者の状態が変化したときに、ECOG Performance Score ⑼に準拠したスコアが記録されている。図6に実際に格納されているデータ例を示した。がんゲノム検査実施時に収録される項目は、「Pre–Sequence」(*6として示された事項であり、検査後の治療経過追跡により「Post–Sequence」(*7と示した事項が追記されていく構造である。a. 治験データベースb. 臨床がんゲノムデータベース二群に偏りなくランダム割り付け治療法A(新薬など)治療法(従来薬、偽薬など)特定のがん種 治療結果診療に訪れたすべてのがん種がんゲノム検査遺伝子変異Aによる治療遺伝子変異Bによる治療遺伝子変異Cによる治療・・・治療結果図4 がんゲノムデータベース協力病院協力病院協力病院事務局衛生検査所衛生検査所臨床情報臨床情報臨床情報QC情報中央病理診断QC情報病理画像QC情報シーケンスデータEDCシステムVPN• 臨床情報管理• アクセス制限• 2段階認証検体の流れデータの流れ臨床がんゲノム統合データベース統合データベースシステム臨床情報治療レスポンスゲノム変異情報図5 オンライン化された臨床がんゲノムデータベースの構成図【モデルデータ】201X年4月診断Endometrioid, Adenocarcinoma, Grade l, stageIA201X年6月手術子宮、卵巣、リンパ節郭清201X年7月~11月AdjuvantPTX+CBPLA 6コース→CR201Y年3月再発総腸骨リンパ節転移あり201Y年3月~5月1st LINEADM+CDDP 2コース→PDPETで左鎖骨上L/N Meta転移有201Y年6月PleSSision検査受診TMB-H, MSI-H→ICI療法推奨あり201Y年7月~12月Pembrolizumab 単剤12コース→CR現在無治療Pre-sequencePost-sequence【臨床経過データモデル】• イベント• 診断(生検)• 手術• 化学療法• NAC, Adj, 1st Line, 2nd Line…• レジメン• 治療レスポンス• RECISTガイドライン• CR 完全奏効• PR 部分奏効• SD 安定• PD 進行• Performance Status• ECOG PS• 0 日常生活支障なし• 1 歩行、軽作業可能• 2 歩行可能で身の回りはすべて可能だが、日中の50%以上はベッド• 3 限られた身の回りのことのみ• 4 全く動けない図6 当社がんゲノムデータベースの臨床データモデル(2) ドライバー遺伝子変異のスコアリング(PleSSisionScore)がんゲノム検査にて検出された遺伝子変異の評価スコアリングシステムを備えていることが当社のがんゲノムデータベースの最も際立った特徴の1つである。がんゲノム検査により、数多くのがん組織の体細胞変異が同時に検出される。これらの変異の中でドライバー遺伝子変異として発がんに関わる強さを0~5の数値で表したスコアである(図7)。通常、がんゲノム検査の結果からドライバー遺伝子変異を抽出する作業は、がんゲノムのエキスパートの手に委ねられることが多いが、PleSSision Score はがんゲノム検査の解析プログラムにより自動的に付加される仕組みになっており、属人性を排した再現性と客観性の高い評価スコアである。これにより、多数の症例が収録されたデータベースからドライバー遺伝子変異の候補を簡単に検索できるようになった。4 MSS 技報・Vol.325.当社のがんゲノムデータベースによる患者層別化の試みこれまで述べたように、分子標的薬が免疫チェックポイント阻害薬を効果的に使用するためには、患者群を奏効可能性の高いグループに層別化することが望まれる。精度の高い患者層別化は、効果の薄い投薬を減ずることが可能になり、不要な副作用減や経済的負担減、さらに社会全体では医療費削減につながる大変重要な事項である。これまで患者層別化は、基礎研究により解明された疾患の要因と治療薬の作用機序により予測されたパラメータ(診断情報)で患者群を階層化し、治験によりOS(*8やPFS(*9を見ることによって、奏効可能性の高い患者層の判別方法を証明するという方法がとられていた。しかしこの方法では、特定のがん種に関して、かつ、患者リクルート条件の中での層別化は可能であるが、一般診療で取扱う多様な症例に対する複数がん種にまたがる層別化は非常に困難である。当社のがんゲノムデータベースは、一般診療の症例データの蓄積を目的としているため、特定のがん種に限定されず多様なものが収録されている。また、年齢、病期を始めとする患者背景に関しても、治験によるデータベースに比べると多様性に富んでいる。このような当社データベースの特徴を生かすためには、がん種横断的に患者の病態を表す指標が必要になる。がんゲノム検査は、まさにそのために行う検査であり、前述のドライバー遺伝子変異スコアリングPleSSisionScore により、分子標的薬の奏効が期待できるかどうかを判定することができる(図8)。一般診療向けのがんゲノム医療として実施したCLHURC 検査⑽ の治療追跡結果( 表1) に関して、PleSSision Score を用いて再評価を実施したところ、図11 の「①ゲノム医療奏効域」には全体の30 % の症例が入ることがわかった。また、表1に示す治療結果から、同領域の奏効率を算出したところ80 % となった。これは、がんゲノム変異に基づく治療全体の奏効率(* 10である47 % に比べ非常に高く、PleSSision Score による患者層別化が可能であることを示唆している(当社調べ)。免疫チェックポイント阻害剤の奏効に関する層別化パラメータであるTMB に関して、Pre–Sequence の臨床経過との比較を示したものが図9である(当社調べ)。発がん・悪性化に寄与するドライバー遺伝子変異の強さ(PleSSision Score)ドライバー因子に対応した治療エビデンスレベル①ゲノム医療奏効域③癌腫別エビデンス対応領域(従来型)②治療薬が待たれる領域(治験・適応拡大)治療ターゲット明確がん発症メカニズムを解明すべき領域(治療の有効性有害事象の頻度)④治療困難領域図8 患者層別化マップの考え方10. Detailed information regarding post-sequencing treatmentPatient Primary site Targeted gene alteration Treatment Genotype-matched Best response007 Esophagus BRCA loss 5-Fluorouracil + Cisplatin No SD010 Esophagus PIK3R1 loss Everolimus No SD012 Breast Germline PTEN R130* Everolimus No PD030 Breast PIK3CA H1047R Everolimus + S-1 Yes PD045 Colorectal FBXW7 R465H Propagermanium No PD048 NSCLC EGFR E746_S752V Gefitinib Yes CR051 Urothelial ERBB2 amp Trastuzumab Yes PR057 Colorectal EGFR S464L Panitumumab + Irinotecan No SD074 Breast AKT1 E17K AKT inhibitor + Fulvestrant Yes SD081 Breast AKT1 E17K AKT inhibitor Yes SD083 Ovary PIK3CA amp Everolimus Yes SD084 Breast Germline BRCA2 D1990A Carboplatin + Paclitaxel No PD095 Colorectal MSH6 loss, TMB-high (12.1 mut/Mb) CapeOX + Bevacizumab No SD096 Breast ERBB2 amp Trastuzumab + Carboplatin Yes PD098 Solid pseudopapillary neoplasm BRCA2 P2612T mFOLFOX6 No SD100 Stomach BRCA1 E1754G Capecitabine + Cisplatin + Trastuzumab Yes PR110 Esophagus ERBB2 amp Capecitabine + Cisplatin + Trastuzumab Yes PR133 NSCLC ERBB2 G778_P780dup Trastuzumab Yes PR136 Breast PIK3CA amp Everolimus + Exemestane Yes PD137 Endometrial MTOR Q1492L Everolimus + Letrozole No PD141 Head and neck ERBB2 S310Y Trastuzumab + Docetaxel Yes PR142 Endometrial PIK3CA H1047R Everolimus + Letrozole Yes SD146 Colorectal FBXW7 R393* Propagermanium No PD147 Pancreas ARID1A Y462* mFOLFOX6 No PD148 Neuroendocrine carcinoma TMB-high (120.8 mut/Mb) PD-1 inhibitor Yes CR149 Vagina Germline BRCA2 G3355Vfs*28 Olaparib Yes SD150 Esophagus BRCA2 K2538T 5-Fluorouracil + Cisplatin Yes PR157 Colorectal BRCA2 S2670L mFOLFOX6 Yes PD・ドライバー変異候補検出率91%・変異に基づく治療推奨率46%(エビデンスD以上)・変異に基づく治療実施率11%上記治療実施例中- 奏効率(PR/CR) 47%- 病態制御率(SD以上) 76%表1 がんゲノム検査に基づく治療結果の例(CLHURC 検査中161 症例の追跡可能な28 症例)⑽腫瘍クローンのポピュレーション評価を加点変異の機能を加点(主にデータベースを参照)コピー数変異の効果を加点Oncogene・増殖パスウェイの亢進・リン酸化の亢進Suppressor gene・タンパク質機能の喪失・発現のロスOncogene・増幅Suppressor gene・LOH, Bi-allelic・Homozygous Deletion非常に弱いTolerant弱いWeak強いStrong非常に強いVery Strong1 2 3 ≧4治療薬を推奨できるドライバー他に選択肢が無い場合治療薬を推奨できるドライバードライバーとして採用できないドライバー変異が備える特徴を点数化し個別層別化スコアとして使用する図7 がんドライバー遺伝子変異の強さのスコア(PleSSision Score)0100200300400500600PR CR PR SD PD SD PD PD PD PD PD PD PD PD PRTMB(Tumor Mutation Burden)Nonsynonymous Mutations/Sample患者治療歴における免疫チェックポイント阻害剤を含むレジメンの治療ベストレスポンス(RECISTガイドライン基準)1,277CR:完全奏効PR:部分奏効SD:安定PD:進行出典:当社調べ図9 がんゲノム変異負荷量(TMB)と免疫チェックポイント阻害剤奏効の関係5 MSS 技報・Vol.32同図から、TMB 値が約200 を境に効きやすくなっている傾向が見える。ただし、TMB が非常に低い症例でも奏効している例があり、それがTMB 検出の問題に起因しているのか、免疫チェックポイント阻害剤の奏効機序に関係しているのかに関しては現時点では分かっておらず、今後の研究の進展により解明されることが期待されている。6.がんエクソームシーケンスによる全遺伝子変異のデータベース化現在、保険診療にて供されているがんゲノム検査は、350 以下の遺伝子を対象としたものに限られている。ヒトゲノムには約2万の遺伝子がコードされており、その中でがんの発症に強く関連する遺伝子は800 程度であることが知られている⑾。しかし、がんの発症機構は非常に複雑であり、がんゲノム研究は現在も精力的に進められ、いままで知られていなかった遺伝子の変異ががんの発症に関わっていることがしばしば発見される。例えば近年、東アジア人において膵臓がんのかかりやすさに関連していると考えられる遺伝子変異としてrs78193826 ⑿が新たに発見された。当該変異をコードしているGP2遺伝子は、これまでがん関連遺伝子としては認識されていなかった遺伝子である。このように、がんに関係する全ての遺伝子変異を知るためには、全遺伝子のシーケンスであるがんエクソームシーケンスが望ましい。特に、免疫チェックポイント阻害剤の奏効に関しては、これまで知られていなかった様々な遺伝子の関係性が解明されつつあり⒀、それらの検出を迅速に診療に取り込むためには、がんエクソームシーケンスが必須になる。そこで、当社ではがんエクソームシーケンスPleSSision Exome ⒁を実用化するとともに、1,000 症例以上のがんエクソームシーケンス結果をデータベース化して活用するプロジェクトが進行中である(図10)。がんエクソームシーケンス1,055 症例のドライバー遺伝子変異解析結果を図8の患者層別化マップ形式にあてはめたものが図11 である。マス目の中の数字は、1,055症例のがんエクソームシーケンス結果から検出されたがんの発症に関わると考えられる遺伝子変異の数であり、検出の総延べ数が示されている(当社調べ)。7.がんゲノムデータベースから画期的創薬や新しい生命保険特約などの開発に向けてこれまで述べたように、実臨床のがんゲノムデータベースにより症例の層別化が進展し、患者への利益と医療経済的な利益の両面をもたらすことが期待できる。さらに、がんゲノムデータベースは新薬の開発や医療関連サービスの開発についても多大な貢献が期待されている。例えば、図11 の「②治療薬が待たれる領域」に含まれる症例に関しては、既存薬剤の適応症拡大や新薬の投入が望まれている。がんゲノムデータベースには、この領域における治療ターゲット遺伝子と症例の発生密度情報が含まれており、薬剤上市後の潜在市場規模が一目瞭然となる。表2は、そのように出現が期待されている薬剤のリストである。「②治療薬が待たれる領域」の階層に含まれる患者層は、ドライバー遺伝子変異が明確な群であるため、治療薬があれば高い奏効率が期待できる群である。この情報を用いることで、ハイリスクと言われる創薬事業にて、困っている多くの患者層に確実性の高い新薬を届けることが可能になる。今後、がんゲノム医療は確実に進展していき、患者の層別化もより精緻なものになることが予想されている。原理的にがん遺伝子変異は個人ごとに異なるため、究極の層別化は個人ごとに最適な医療をマッピングすることである。そこまで極端に進展するには相当時間がかかると思われるが、今後、同じがん種でも数十~数百のグ変異プロット(縦軸:遺伝子、横軸:症例、グラデーション:変異の影響度)CNVプロット(縦軸:遺伝子、横軸:症例、グラデーション:増幅(赤色)、欠損(青色))出典:当社調べ図10 がんエクソーム変異解析結果のプロット例(N=1,055)0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5A 2 13 64 18613149446B 151431C 6 48 31823378181D 1 11 75 165 91515 1E 147 713 653 2565 4382 1989181変異が検出された遺伝子の治療エビデンスレベルドライバー遺伝子変異の強さ(PleSSision Score)③癌腫別エビデンス対応領域 ①ゲノム医療奏効域②治療薬が待たれる領域(治験・適応拡大)④治療困難領域出典:当社調べ図11 がんエクソーム変異解析結果の層別化マップ例6 MSS 技報・Vol.32ループに細かく分類される時代はまもなく訪れると考えられる。非常に困ったことに、最初に述べたdbRCT による治療法開発は、そのように細かく分類された患者群の取り扱いが不得手であり、これは、がんゲノム医療と日本の皆保険診療システムとの相性があまり良くないことを示唆している。そのような状況を打破する一つの方策として、損害保険や生命保険の特約等の形式で、薬剤の適応外使用をサポートすることが検討されている(表3)。保険設定において、奏効可能性の高い患者層の密度分布や、奏効率などは非常に重要なパラメータとなる。従来はそのようなパラメータを得ることは非常に難しかったが、がんゲノムデータベースによりそれらの情報が確実に入手できるようになる。8.むすびこれまで、臨床データベースのゴールとしては、人工知能(AI)の応用による病気の診断精度の向上や診断自動化などが注目されてきた。もちろんAI の応用なども重要であるが、本論においては、さらに将来患者に直接的な利益をもたらす効果として、患者層別化手法の開発を通じてあらたな治療薬開発の加速や、がんゲノムを応用した個別化医療をサポートする保険商品の開発によって治療の経済的な負担軽減が社会的なゴールとして設定できることを示した。最後に、本論をまとめるにあたり貴重なデータ及びご指導をいただいた、慶應義塾大学医学部 腫瘍センターゲノム医療ユニットの西原 広史教授、林 秀幸講師、四十物 絵理子助教、中村 康平助教、今井 光穂助教及び同ユニットの皆様方に深くお礼を申し上げる。 *1 実臨床で得られた検体や臨床情報、ゲノム情報から基礎研究等に必要な基礎情報を得ること。*2 患者だけではなく治験薬を処方する医師も、それが新薬か偽薬かを知らされていない試験方法。最も結果にバイアスが加わりにくい試験手法と言われている。*3 がん組織に生じたゲノム変異数の総数、または単位長当たりの数。ヒト自身の免疫系ががん細胞を識別するための指標として考えられた。*4 細胞増殖時に生じるDNA の変異を補正する遺伝子に異常が生じた場合、ヒトゲノム上のマイクロサテライト領域(全ゲノム上に満遍なくちりばめられている)と呼ばれるDNA 繰り返し配列の長さが変異する現象。これも、免疫系の識別に関わると考えられている。*5 臨床研究などにおいて診療データを取集するソフトウェアのことをEDC(Electric Data Capture)と呼んでいる。*6 がんゲノム検査を実施するまでの臨床履歴のこと。*7 がんゲノム検査実施後の臨床履歴。これは、がんゲノム検査結果の影響を受けていると考えられる。*8 Overall Survival:全生存期間。治療開始後、生存した期間。*9 Progression Free Survival:無増悪生存期間。治療開始後、病態増悪が認められるまでの期間。* 10 治療によりがん組織が完全消失(CR:CompleteResponse)、または、サイズが3割以上縮小(PR:Partial Response)した症例の分布密度。目的主な年齢層診療内容費用概算公的保険がん保険今後保険のサポートが望まれる領域発症前早期発症リスクを知る小児~中年ゲノム検診(遺伝性疾患の健康診断)50万円〇発症後確定診断後の一時金中年以降〇家族性腫瘍の検査早期がんの場合生殖細胞系列ゲノム検査40~50万円一部の癌腫定額給付金標準治療終了後のがんゲノム検査中年以降保険診療によるがんゲノム検査数万円~17万円〇治療中年以降患者申出療養制度受皿試験NCCH1901約40万円〇治療中年以降先進医療数百万円特約で対応再発後任意のタイミングでのがんゲノム検査中年以降自費診療によるがんゲノム検査(PleSSision検査)60~100万円〇再発直後のがんゲノム医療中年以降薬剤の適応外使用数百万円~千数百万円〇出典:当社調べ表3 今後保険のサポートが望まれる領域No. Experimental Drugs1 CTNNB1 Inhibitor2 EZH2 inhibitor3 WNT Inhibitor4 HDAC Inhibitor5 PI3K Inhibitor (Pan)6 RET Inhibitor7 ROS1 Inhibitor8 ATR Inhibitor9 CDK4/6 Inhibitor10 BET Inhibitor (Pan)前臨床レベルのエビデンス出現頻度の高い上位10阻害薬(# of Pts : 1,055)図11の「②治療薬が待たれる領域」に相当する候補治療薬剤のリスト出典:当社調べ表2 今後治療薬の開発が望まれるドライバー遺伝子の阻害薬リスト7 MSS 技報・Vol.32参考文献(1) 毛利 涼,岡村 容伸,野原 祥夫,谷嶋 成樹:がんゲノムデータ解析:臨床現場への実装,MSS 技報,27(2017)https://www.mss.co.jp/technology/report/pdf/27_04.pdf(2) 谷嶋 成樹:がんクリニカルシークエンスの動向,MSS 技報,28(2018)https://www.mss.co.jp/technology/report/pdf/28_06.pdf(3) 厚生労働省:がんゲノム医療提供体制におけるがんゲノム医療中核拠点病院等一覧表「がん診療連携拠点病院等」https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/kenkou/gan/gan_byoin.html(4) 谷嶋 成樹:がんゲノム医療における始まりの終わりの始まり,MSS 技報,30(2020)https://www.mss.co.jp/technology/report/pdf/30_06.pdf(5) Li,L.:Reverse Translational Pharmacology ResearchIs Driven by Big Data,CP:Pharmacometrics Syst.Pharmacol.,7,No.2,63 ~ 64(2018)(6) Friedman,A. A.,Letai,A.,Fisher,D. E.,et al.:Precision medicine for cancer with next–generation functional diagnostics,Nat. Rev.Cancer,15,No.12,747 ~ 756(2015)(7) Maleki Vareki,S.:High and low mutational burdentumors versus immunologically hot and cold tumorsand response to immune checkpoint inhibitors,J.Immunother. Cancer,6,No.1,157(2018)(8) 日本臨床腫瘍研究グループ(JCOG):固形がんの治療効果判定のための新ガイドライン(RECIST ガイドライン)-改訂版 version 1.1 -日本語訳JCOG 版ver.1.0(2010)http://www.jcog.jp/doctor/tool/recistv11.html(9) 日本臨床腫瘍研究グループ(JCOG):ECOG のPerformance Status(PS)の日本語訳http://www.jcog.jp/Cancer Therapy Evaluation Program:CommonToxicity Criteria,Version 2.0(1999)http://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/ctcv20_4-30-992.pdf(10) Hayashi,H.,Tanishima,S.,Fujii,K.,et al.:Clinical impact of a cancer genomic profiling testusing an in–house comprehensive targetedsequencing system,Cancer Sci.,111,No.10,3926~ 3937(2020)(11) Sondka,Z.,Bamford,S.,Cole,C. G.,et al.:TheCOSMIC Cancer Gene Census: describing geneticdysfunction across all human cancers,Nat. Rev.Cancer,18,No.11,696 ~ 705(2018)(12) Lin,Y.,Nakatochi,M.,Hosono,Y.,et al.:Genome–wide association meta–analysis identifiesGP2 gene risk variants for pancreatic cancer,Nat.Commun.,11,No.1,3175(2020)(13) Keenan,T. E.,Burke,K. P.,Van Allen,E. M.:Genomic correlates of response to immunecheckpoint blockade,Nat. Med.,25,No.3,389 ~402(2019)(14) 三菱スペース・ソフトウエア株式会社:News &Topics(2019 年3 月11 日)https://www.mss.co.jp/information/news.html執筆者紹介谷嶋 成樹1989 年入社。関西事業部へ配属後、防衛関連システム、気象レーダシステム、電力系統制御システムのソフトウェア開発に従事。1999 年からバイオインフォマティクス・ゲノム解析のシステム開発、アルゴリズム研究業務に転向。2014 年世界初のiPS 細胞を用いた臨床研究「加齢黄斑変性に対する自己iPS 細胞由来網膜色素上皮シート移植」の共同研究グループに参画し、全ゲノムデータ解析を実施した。現在、関西事業部バイオメディカルインフォマティクス開発部 部長。