テクノロジー
技術レポート:アーカイブ
Category:ライフサイエンス
がんゲノム医療における始まりの終わりの始まり
「がん」は原発臓器ごとに決められた治療プロトコルに基づき診断され治療法の選択がなされてきた。ところが近年のゲノム科学の進歩により、がんの発症原因は遺伝子変異の種類にかかっており対応する分子標的薬により個別化治療を行う「がんプレシジョンメディシン(がん精密医療)」が徐々に導入され、臨床現場にてがんゲノムデータと治療経過情報の蓄積が進んでいる。がんゲノム医療は初期の立ち上がり段階を終えて、本格的な評価が始まり逐次手法が改善される第二段階に突入したと考えられる。
参考情報:
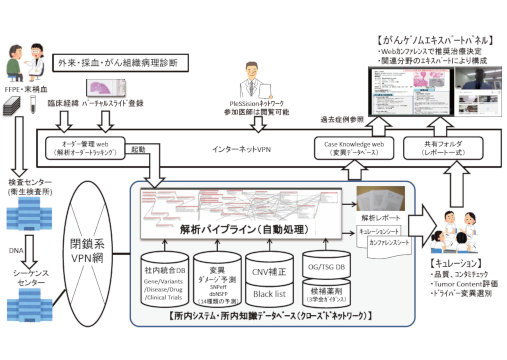
1 MSS 技報・Vol.30 がんゲノム医療における始まりの終わりの始まり The Beginning of the End of the Beginning in Cancer Genomic Medicine 谷嶋 成樹*Shigeki Tanishima 「がん」は原発臓器ごとに決められた治療プロトコルに基づき診断され治療法の選択がなされてきた。ところが近年のゲノム科学の進歩により、がんの発症原因は遺伝子変異の種類にかかっており対応する分子標的薬により個別化治療を行う「がんプレシジョンメディシン(がん精密医療)」が徐々に導入され、臨床現場にてがんゲノムデータと治療経過情報の蓄積が進んでいる。がんゲノム医療は初期の立ち上がり段階を終えて、本格的な評価が始まり逐次手法が改善される第二段階に突入したと考えられる。 We had been selecting treatment of cancer from standard treatment which is based on primarysite. However, progress of genome science in recent years revealed that clinical cancer genomesequencing decides cancer driver genotypes, so “cancer precision medicine”, which is personaltreatment based on molecular targeting drugs, is gradually prevailing.In the clinical field, cancer genome data and knowledge of therapeutic course start to be assumed.Cancer genomic medicine is considered to have entered the second stage after the initial start–upstage and full–scale evaluation has begun. *関西事業部 バイオメディカルインフォマティクス開発部 1.がんゲノミクス研究からがんゲノム医療へ 2013 年 世界的に著名な医学雑誌のThe New EnglandJournal of Medicine のEditorial(編集後記)に「がんゲノミクス研究の始まりの終わりの始まり」という記事が掲載され、そこでは当時の状況を表す次のようなことが記されていた⑴。(1) ヒトゲノムプロジェクトの完了宣言から10 年間経過し、「がん」や遺伝性の希少疾患の大規模ゲノムシーケンスが進められている。(2) これから2年以内に主要な新規遺伝子は発見されつくされるだろう。(3) 臨床試験の現場においては、薬剤の研究開発に関してアカデミックな機関が再びその役割を拡大していく。(4) 大規模なゲノムシーケンシングが臨床現場の治療へと持ち込まれる。(5) ゲノムデータをいかにして迅速に医師へと提供できるようにするかが克服するべきハードルのひとつとなる。上記から6年経過し、2019 年(令和元年)には、ついに我が国でも保険診療にてがんゲノム医療の受診が可能になった。これは、上記の最後の項目で「克服すべきハードル」として示された、医師へのゲノムデータの提供の手法が完成したことを意味する。本邦にて保険診療が開始されたことを機に、がん疾患の撲滅に向けた個別化医療(Precision Medicine)を実現するためのハードルについて述べていきたいと思う。2.がんゲノム医療の課題と将来像悪性腫瘍(がん)の悪性度や振る舞いは原発臓器に大きく依存している。そのため、標準治療は原発臓器ごとに研究開発され承認されてきた。ところが近年のゲノム科学の進歩により、がんの発症原因は原発臓器に関わらず遺伝子変異にかかっており、治療もその遺伝子変異に対応した分子標的薬を処方すれば臓器に関わらず治療可能なことがわかってきた。これらのがん治療の基本的な特徴に関しては、MSS 技報Vol.27 ⑵及びVol.28 ⑶を参照されたい。今回は、実臨床に応用されたことで初めて判明した課題とそれらを克服した将来像について述べる。2.1 がんゲノム医療の現状現在、国内で受診可能ながんゲノム医療のワークフローを図1に示す。2 MSS 技報・Vol.30がんゲノム医療を現場の医師に迅速に提供することができるようになったのは、図1に示す「知識ベース」及び関連分野の医師らによる「エキスパートパネル」の機能により、診断と治療に関連する遺伝子変異を確実に抽出し、遺伝子変異に基づく推奨治療を示すプロセスを標準化できたためである。2.1.1 がんゲノム医療には知識ベース活用が必須知識ベースとは、これまでの世界中のがんゲノミクス研究成果が集積された公共データベースである、COSMIC ⑷及びClinVar ⑸が最も著名なデータベースである。COSMIC はがんの体細胞変異(がんの発症に直接関わるドライバー変異を含む変異)、ClinVar は遺伝性腫瘍に関わる遺伝子変異を収録している。臨床検体から検出された変異ががんの発症に関わるかどうか(Oncogenicity)を判定するための最も基本的な情報である。臨床検体から得られた変異はCOSMIC 及びClinVar を参照してもOncogenicityが不明な場合が多い。その場合は、VUS(Variant of Uncertain Signifi cance)と呼ばれ、更に詳細な知識ベースにより処理される。当社が運用するPleSSision 検査⑹(図2参照)の場合は、複数の研究機関とのライセンス契約により、変異のOncogenicity を評価するデータベースを得て、それらを統合することで、当社独自のVUS 解消データベースを構築している。一般には、OncoKB ⑺、CIViC ⑻、Cancer GenomeInterpreter ⑼等のアカデミック向けデータベースが利用されることが多い。2.1.2 エキスパートパネルとはエキスパートパネルは、がんゲノム医療の専門家委員会であり、臨床現場にて各症例を対象に実施される。厚生労働省の「がんゲノム医療中核拠点病院(仮称)等の指定要件に関するサブワーキンググループ」によると、症例の主治医、がん薬物療法、遺伝医学、病理学に関する専門知識を有する医師、分子遺伝学やがんゲノム医療に関する研究者、がんゲノム研究に関するバイオインフォマティクス専門家の参加が必須とされている。これらのメンバーにより、検査全体の品質、検出された遺伝子変異に関するOncogenicity、推奨される治療のエビデンスレベル及び遺伝性腫瘍に関わる変異の位置づけに関してコンセンサスを得ることにより、検査結果及び推奨治療のレベルの標準化を実現している。次世代ゲノムシーケンサ解析パイプラインソフトウェア知識ベース(遺伝子変異カタログ)知識ベース(推奨治療エビデンス)推奨治療検索変異キュレーション(ゲノム解析専門家)エキスパートパネル(関連分野の医師)がん組織の採取化学療法治療経過・奏効蓄積した治療経過の評価蓄積した変異情報の評価主治医アップデートアップデート推奨治療図1 がんゲノム医療のワークフローオーダー管理web(解析オーダートラッキング)Case Knowledge web(変異データベース)共有フォルダ(レポート一式)シーケンス閉鎖系VPN網社内統合DB 変異ダメージ予測Black listCNV補正候補薬剤(3学会ガイダンス)解析パイプライン(自動処理)Gene/Variants/Disease/Drug/Clinical TrialsSNPeffdbNSFP(14種類の予測)解析レポート【所内システム・所内知識データベース(クローズドネットワーク)】OG/TSG DBキュレーションシートカンファレンスシート【キュレーション】・品質、コンタミチェック・Tumor Content評価・ドライバー変異選別検査センターDNAインターネットVPN外来・採血・がん組織病理診断FFPE・末梢血臨床経緯バーチャルスライド登録PleSSisionネットワーク参加医師は閲覧可能【がんゲノムエキスパートパネル】・Webカンファレンスで推奨治療決定・関連分野のエキスパートにより構成過去症例参照起動(衛生検査所)センター図2 がん遺伝子検査(PleSSision 検査)システムの全体像3 MSS 技報・Vol.302.1.3 推奨治療がんゲノム医療により、Genotype Matched Treatment(がんゲノム検査結果に基づく推奨治療)と総合的判断に基づく推奨治療の2種類の推奨治療が示される。Genotype Matched Treatmentは、知識ベースによって得られた推奨治療である。通常、知識ベースによって、複数の推奨治療を含むリストが得られる(図3a参照)。エキスパートパネルによって、これらの中から最も医学的なベネフィット/リスクが大きいと考えられるものがGenotype Matched Treatment として選択される。これらは純粋に医学的見地から検討されるため、治験薬や国内で入手不可能な薬剤が含まれる場合もある。これらは、将来国内向けに新薬の治験や臨床研究が開始された場合に必要な情報となる。通常は、他癌腫で既に承認された薬剤や、国内でエントリ可能な治験を治療手段として選択する。これらは、エキスパートパネルのメンバーでコンセンサスを得たのちに総合的判断に基づく推奨治療として主治医に提示される(図3b参照)。■ID 099005984500■ゲノムプロファイルCTNNB1 S45F(PLS=3); PTEN R130*(PLS=2/3); CDK4 amp(PLS=3); MDM2 amp(PLS=3); TMB high(TMB=16,PLS=3) (CTNNB1 S45F;CTNNB1 act mut;PTEN R130*;PTEN inact mut;CDK4 amp;MDM2amp;TMB high)■Primary Site Kidney■同一癌腫の治療エビデンスprofile_id profile_name evidence_type USLevelJPLevelPleSSisionSite therapy(drug) response_type indication efficacy_evidence approval_status2169 MDM2 amp TP53wild-type Actionable C CAdvancedSolidTumorAMG 232 predicted -sensitiveAdvanced SolidTumorIn a Phase I trial, AMG 232 demonstrated acceptable safety, and resulted in stabledisease in 62.5% (10/16) of patients with TP53 wild-type, MDM2 amplified solid tumorsother than liposarcoma, glioblastoma, and breast cancer, with a median duration of 3.3months, and a patient with squamous cell carcinoma achieved unconfirmed partialresponse per central evaluation (PMID: 31359240; NCT01723020).Phase I29716 TMB high Actionable C C Kidneyunspecified CTLA4antibody + unspecifiedPD-1 antibodypredicted -sensitiverenal cellcarcinomaIn a retrospective analysis, patients with renal cell carcinoma (n=151) and a high tumormutational burden (TMB) (>5.9 mutations/Mb) demonstrated an improved overallsurvival and time to next treatment compared to those patients with a low TMB whentreated with a combination of an unspecified CTLA-4 antibody and an unspecified PD-1antibody (PMID: 30643254).Clinical Study -Cohort■他癌腫の治療エビデンスprofile_id profile_name evidence_type USLevelJPLevelPleSSisionSite therapy(drug) response_type indication efficacy_evidence approval_status1422 CDK4 amp Actionable B C Sarcoma Palbociclib sensitive liposarcoma In a Phase II trial, treatment with Ibrance (palbociclib) improved median progression freesurvival of liposarcoma patients with CDK4 amplification (PMID: 23569315). Phase II4008 CTNNB1 S45F Actionable C C Sarcoma Imatinib sensitive desmoid tumorIn a retrospective analysis, patients with desmoid fibromatosis harboring CTNNB1 S45Fdemonstrated a greater progression arrest rate at 6 months compared to CTNNB1 wildtypepatients (85% vs 43%, p=0.05) when treated with Gleevec (imatinib) (PMID:26861905).Clinical Study -Cohort■否定的エビデンスprofile_id profile_name evidence_type USLevelJPLevelPleSSisionSite therapy(drug) response_type indication efficacy_evidence approval_status28174 CDK4 ampMDM2 amp Actionable D D NSCLC Pembrolizumab no benefitlungadenocarcinomaIn a clinical case study, a patient with lung adenocarcinoma that harbored CDK4amplification and MDM2 amplification quickly progressed after receiving Keytruda(pembrolizumab), resulted in new brain metastasis and clinical progression 1.5 monthsafter treatment (PMID: 28351930).CaseReports/CaseSeries3638 CTNNB1 act mut Actionable NA NA Liverunspecified CTLA4antibody + unspecifiedPD-1 antibodydecreasedresponsehepatocellularcarcinomaIn a clinical study, treatment with immune checkpoint antibodies, including anti-PD-1,anti-PD-L1, or anti-CTLA-4 monotherapy or combinations of anti-PD-1 with anti-CTLA-4,anti-LAG3, or anti-KIR, was less effective in patients with Wnt pathway mutations inCTNNB1 or AXIN1 compared to patients without mutations in this pathway, with 0%(0/10) vs. 53% (9/17) achieving disease control, respectively, and shorter progressionfreesurvival (2.0 months vs. 7.4 months) (PMID: 30373752; NCT01775072).Clinical Study -Cohort■検査結果プロファイル:CTNNB1 S45F; PTEN R130*; CDK4 amp; MDM2 amp; TMB high図3a がん遺伝子検査エキスパートパネルのアウトプット例(治療エビデンスリスト)■検査結果プロファイル:CTNNB1 S45F; PTEN R130*; CDK4 amp; MDM2 amp; TMB high図3b がん遺伝子検査エキスパートパネルのアウトプット例(カンファレンスシート)4 MSS 技報・Vol.302.2 がんゲノム医療の成果2019 年10 月28 日版の日経バイオテクONLINE ⑽によると、がんゲノム医療の「がん遺伝子プロファイルに基づく推奨治療(Genotype Matched Treatment)」実施率は、13 % である(図4参照)。林ら⑾によると、国内外にて実施される5つの試験において同実施率は8% ~16 % 程度と報告されている。これは、エキスパートパネルの結果得られた推奨治療率であるアクショナブル変異検出率の37 % ~ 86 % に比べると1/3 ~ 1/4 であり、非常に低く、改善が求められる部分である。次に、改善すべき課題に関して論じていく。2.2.1 がんゲノム検査は精度的に成立している当初、がんゲノム医療が開始される直前までは、がんゲノム医療に提示される検体(ホルマリンで固定された癌の手術検体や生検検体)の精度にばらつきが大きいことから、がんゲノム検査そのものが精度的に成立するかどうかが、危惧されていたが、日経バイオテクONLINE ⑽や林ら⑾の報告により、シーケンス成功率は89 % 以上、がんの発症に関わる遺伝子変異の検出率が83 %以上の水準を得られていることから、がんゲノム検査の精度的な面では成立しており、大きな問題点は無いと考えられる。2.2.2 治療に至った場合の奏効率は良好図4に示すとおり、Genotype Matched Treatment の実施に至った症例においての奏効率は38 %である。一般に殺細胞性の抗がん剤や免疫チェックポイント阻害薬の奏効率は10 ~ 30 % といわれており、標準治療不応に至った患者層の治療成績としては非常に良好と考えられる。また、病態制御率は73 % であり、治療に至った場合は高い割合で治療のメリットを享受できることがわかっている。2.2.3 検査受診しても治療に至る割合が低い現時点でがんゲノム医療の対象となる患者層は、図5に示すとおり再発後標準治療が不応になった層である。出典:日経バイテクオンライン2019年10月28日050100150200250300350解析数検出アクショナブル治療がんゲノム医療の実施例TOP-GEAR3 PleSSisionTOP-GEAR乳がんのみ24症例PleSSision奏効割合(PR+CR) 38% 38%病態制御率(CR+PR+SD) 未発表73%治療結果の内訳(ベストレスポンス)83%92%59%59%13%13%Genotype Matched Treatmentの効果標準治療不応の患者層としては良好といわれている【用語説明】CR:Complete Response、腫瘍が完全消失PR:Partial Response、30%以上減少した状態SD:Stable Disease 、変化しない状態PD:Progressive Disease、20%以上増加かつ絶対値でも5mm以上増加した状態、あるいは新病変が出現図4 がん遺伝子プロファイルに基づく推奨治療実施率及び薬剤の奏効率ゲノムプロファイルに基づく治療診断術前化学療法手術再発/転移化学療法緩和ケア/代替療法ステージⅠ/Ⅱに相当ステージⅢ/Ⅳに相当(治験/患者申し出療法/自費)遺伝子検査に基づく治療ゲノムスクリーニング検査PleSSision Rapid 高度検査PleSSision Exome免疫療法、PARP阻害薬術後化学療法不応・標準治療終了・・・がん遺伝子検査(保険診療)コンパニオン検査分子標的薬コンビネーション適応症の拡大最適化最適化悪性度・再発予測遺伝子検査に基づく治療ドライバーが見つからない場合治療困難なドライバー変異が見つかった場合【次世代のゲノム医療】図5 次世代のがんゲノム医療に求められる検査と治療5 MSS 技報・Vol.30図6に示すとおり、検査受診時には全身状態が良好であっても、検査結果が得られて治療が始まる数か月後には、肝臓の転移巣が増大して薬物療法が不可能になっている場合や、不幸にも治療に入れず死亡される場合がある。当社PleSSision 検査の実施結果から、検査時に全身状態良好(ECOG PS 0 又は1)の患者が、4~6週後の検査結果説明時には一般的に治療可能な全身状態といわれるECOG PS 0 ~ 2 に留まれる割合は約6割であった。このような困難な状況下で、更に薬剤の適応外使用に伴う高額な医療費の問題、治験のエントリ条件との整合性の問題から、前述のとおりGenotype MatchedTreatment 実施率が13 % 程度に留まっていると考えられる。2.2.4 治療困難な遺伝子変異PleSSision 検査等のがんゲノム検査によって明確なドライバー変異が得られた場合においても、分子標的薬による治療を無効化する種類のドライバー変異が存在する。表1に示すがん遺伝子変異が検出された場合、同時に検出された他の遺伝子変異にマッチする薬剤を投与しても奏効しないとされている。これは、これらの変異は細胞増殖シグナルパスウェイの下流に位置する因子のため、分子標的薬が数多く存在する上流の遺伝子を阻害しても細胞増殖が止まらないからである。2.2.5 高コストが普及の妨げになっている令和元年6月に保険収載されたがん遺伝子パネル検査の薬価は56 万円である。また、当社のPleSSision 検査をはじめとする自費診療で提供されるがん遺伝子パネル検査の価格は50万円以上であり、いずれも非常に高価な検査である。保険診療で提供されるパネル検査の患者負担は低額で抑えられるが保険財政に与える負担は大きく、その負担を軽減するために、対象者を標準治療終了が見込まれる患者層(1%)に限定せざるを得ないといわれている。また、自費診療で提供されるパネル検査については、そもそも患者自身の経済的負担が大きく、条件の良い民間のがん保険加入者や富裕層等の一部の患者に対象者が限られてしまうという問題点がある。2.3 がんゲノム医療における始まりの終わりの始まり前節で述べたとおり、がんゲノム医療には問題点は多数あるが、治療に至った場合のメリットが非常に大きいことが実証されている。そこで、国内で毎年100 万人発生するといわれている新規癌患者全員ががんゲノム医療のメリットを享受するためにはどうしたらよいだろうか。2.3.1 がんゲノムスクリーニング検査第一に必要なことは、がんゲノム検査のコストダウンである。がんゲノム検査のコストは、試薬代が1/3、情報処理及びエキスパートパネルのコストが1/3、検体の処理及び検査会社の営業コストが1/3 といわれている。まず、ゲノム検査の対象を、早期の患者を対象とすることで、推奨治療より診断を主目的にすることができるためエキスパートパネルを省略することができる。また表1 治療困難な遺伝子変異の例⑿遺伝子変異治療無効化薬剤検査での検出率KRAS G12D/V/R EGFR 阻害薬、HER2 阻害薬PIK3C/ATK/mTOR阻害薬 等約15 %BRAF D594A/H/V/G/N/F/Y 6% 以下■標準治療終了後の適応では治療までの到達率が低い再発後化学療法↓不応転移巣増大PS※ 急速に悪化(0/1→2/3/4)悪液質がんゲノム検査治験エントリ条件からの逸脱自費診療病院探し費用の確保倫理審査待ち個人輸入治療開始死亡を含む治療不応状態1ヵ月程度1ヵ月程度1ヵ月程度患者さんの変化※;ECOG PS(Performance Status)治療を待たずに状態が急速に悪化、治療に至らず再発後化学療法→発症から標準治療終了まではゲノムで最適化されないここまで到達できるのは13%59%の人に薬剤を推奨できている図6 がんゲノム医療実施時期に関する課題6 MSS 技報・Vol.30程度に圧縮することが可能である。慶應義塾大学病院と当社ではこれらの技術を集約して低コストのがんゲノムスクリーニング検査としてシステム化し、PleSSision–Rapid ⒀という名称で現在運用評価を実施している。2.3.2 がんエクソーム(全遺伝子)検査がん遺伝子パネル検査を実施しても明確なドライバー遺伝子変異が得られない場合がある。この場合高い効果を期待できる分子標的薬の推奨は難しい。治療困難な遺伝子変異を有する症例に対しても同様に分子標的薬の推奨が困難なことは2.2.4 項で述べたとおりである。これら、治療対象として有効なドライバー変異を有さない症例に関して、今後有望と考えらえる治療法が2種類存在する。(1) 免疫チェックポイント阻害薬推奨するためには、がん抗原の量、免疫遺伝子、腫瘍免疫抵抗性の検出が必要(2) HRD(Homologous Recombination Defi ciency)症例に対するPARP 阻害薬推奨するためにはゲノム不安定性、HRD の検出が必要これらの治療法の適応を判断するためには、がん遺伝子パネル検査のような限定された遺伝子(160 遺伝子程度)ではなく、ゲノムワイドに全遺伝子レベルの病的変異検出が必要となる。そこで、当社でもPleSSision Exome というがん全遺伝子検査(約2万遺伝子)を開発して臨床現場に提供している。PleSSision Exome により、KRASG12D 陽性症例等の治療困難な遺伝子変異を有する症例においても免疫チェックポイント阻害薬やPARP 阻害薬を的確に推奨するための解析データを得ることができるようになった(図7参照)。当社では、これまでのPleSSision 検査で蓄積されたデータベース(約2,000 件)を活用したドライバー変異推論プログラムの開発に成功したことから、がん遺伝子変異解析レポートの生成を完全に自動化することが可能になった。これらによって、情報処理及びエキスパートパネルに要するコストを1/₂₀ 程度まで圧縮することが可能になる。次に、通常のがん遺伝子パネル検査では「マッチドペア解析」と呼ばれる正常組織(血液)と腫瘍組織を同時に検査に使用する方式を採用している。この方式ではがん組織の体細胞変異や遺伝性腫瘍に関わる生殖細胞系列変異を正確に分類して検出できるという利点があるが、試薬に掛かるコストが高くなるという欠点がある。そこで、腫瘍組織だけを解析して、そこから検出される生殖細胞系列由来の変異は前述のPleSSision 蓄積データベースにてキャンセルして体細胞変異のみを検出することで、使用する試薬の量を半減させることができた。また、次世代シーケンサでDNA 配列を解読する場合のdepthと呼ばれる「読みの深さ」を1/₂ 程度に抑えることで合わせて1/4 程度の試薬量にすることができる。さらに、使用するDNA シーケンサをより大型化することで試薬単価を1/3 程度に圧縮することができる。これによって、試薬にかかるコストを1/₁₂ 程度に圧縮可能となる。最後に、がん遺伝子パネル検査を病院内の実験室で実現する自家調製検査法LDT(Laboratory DevelopedTest)を導入することで、最後の1/3 のコストを大幅に削減することができる。これは、LDT 導入と併せて病院内の病理検査ワークフローをがんゲノム検査を考慮したものに最適化することで、最低限の人員増でDNA シーケンシングを含む検体処理フローを実現できる。これら3つの合わせ技によって、コストを1/₁₆ ~ 1/₂₀図7 がんエクソーム検査PleSSision Exome のメリットOncogene、FusiongeneTumor Suppressor Gene がん増殖のパスウェイ亢進ゲノム不安定性がん免疫低下TMB(質と量)、Indel、HLA、ADCC免疫遺伝子、腫瘍免疫抵抗性DDR遺伝子の失活(BER、MMR、NER、TLS、NHEJ、HR)がん増殖の低下がん細胞死がん免疫の復活PARP阻害薬、プラチナ製剤免疫チェックポイント阻害剤分子標的薬従来のがん遺伝子パネルは「マルチプレックスコンパニオン」という観点がんエクソーム検査(PleSSision Exome)では、ゲノムの全貌を見ることで以下が見えてくる(脱コンパニオン)明確なドライバー変異がない症例の治療効果が期待できる一次的な縮小効果7 MSS 技報・Vol.302.3.3 がんゲノムデータの二次利用による創薬これまで述べたがんゲノムスクリーニング検査PleSSision–Rapid による早期ゲノム診断・薬物治療の最適化、がんエクソーム検査PleSSision Exome による免疫チェックポイント阻害薬やPARP 阻害薬の治療探索を実施しても、なお3割~4割の患者には有効な治療法を推奨できずにがんゲノム医療の対象外となってしまう。これは、対応する治療法そのものが存在しないためと考えられ、今後は、新たなドライバー遺伝子変異の同定と治療法の開発対象候補となるドライバー遺伝子変異の明確化が必要になる。そのためには、全がん患者を対象とする規模でのがんゲノムデータ及び治療経過等の臨床データの蓄積が必要となる。それらは、個人情報であり、かつ、膨大なデータサイズのゲノムデータを含む取り扱いの難しい情報となり従来は巨大データセンターにてデータ蓄積と管理を実施してきた。しかしながら、巨大データセンターは運用コストが膨大であり、かつ、患者のデータ二次利用同意内容の変更処理が非常に困難であるという致命的な問題点がある。そこで、次世代のがんゲノムデータ活用研究においては図8に示すような、データ蓄積を分散型とし、個人情報等二次利用に患者同意を必要とするデータについては、個人クラウドを通じて患者個人に返却しつつ、二次利用業者が必要時にデータを利用できるデータシェアリングネットワークの開発が進められている。これにより全患者がゲノム検査を実施してもコスト的に破綻することなく、長期間データを安全に保管できる環境が確立する。本書をまとめるにあたってご指導をいただきました、慶應義塾大学病院 腫瘍センター がんゲノム医療ユニット 教授 西原 広史 先生、同ユニット 統括マネージャ林 秀幸 先生、同ユニットメンバーの皆様には深く御礼申し上げます。参考文献(1) Steensma,D. P.:The Beginning of the End of theBeginning in Cancer Genomics,N. Engl. J. Med.,368,No.22,2138 ~ 2140(2013)(2) 毛利 涼,ほか:がんゲノムデータ解析:臨床現場への実装,MSS 技報,27(2017)https://www.mss.co.jp/technology/report/pdf/27_04.pdf(3) 谷嶋 成樹:がんクリニカルシークエンスの動向,MSS 技報,28(2018)https://www.mss.co.jp/technology/report/pdf/28_06.pdf(4) Tate,J. G.,et al.:COSMIC: The Catalogue OfSomatic Mutations In Cancer,Nucleic Acids Res.,47,No.D1,D941 ~ D947(2019)(5) Landrum,M. J.,et al.:ClinVar at five years:Delivering on the promise,Hum. Mutat.,39,No.11,1623 ~ 1630(2018)(6) Aimono,E.,et al.:“PleSSision”: A PathologistEdited Multigene Genomic Test Promotes CancerPrecision Medicine in Japan,J. Mol. Diagn.,20,No.6,1011(2018)(7) Chakravarty,D.,et al.:OncoKB: A PrecisionOncology Knowledge Base,J. Clin. Oncol.: Precis.Oncol.(2017)がんゲノムパネルシーケンシングが臨床現場の治療へと持ち込まれ、得られたデータを適切に医師へと提供できるワークフローが完成し、がんゲノムの初期のハードルはクリアされた。公的保険のサポートも開始されて、世間にがんゲノム医療が知れ渡るが、主にコストの問題から、恩恵にあずかれる患者はごく一部に限られる。特にゲノム検査のコストダウンが急務になる。同時にがんパネルシーケンスの限界(治療に結び付くのが10~15%)が露呈し、臨床現場は全患者を救うためにエクソームシーケンス(全遺伝子)や全ゲノムシーケンスなど、さらに高度で複雑な遺伝子プロファイルを求めることになるだろう。治療効果の蓄積が進み、そこから次世代の分子標的薬、免疫療法、殺細胞性抗がん剤の開発が加速される。その際にリアルワールドの臨床ゲノムデータをいかに的確に創薬に結び付けるかが、長期的にがんゲノム医療を成功させるカギとなる。図9 がんゲノム医療における始まりの終わりの始まりベンダー横断的なクラウドストレージアプリアプリデータ利用者(研究者・業者)アプリアプリAPIユーザーデータの実体アクセス権アクセス権アクセス権患者A患者B患者C主治医や遺伝カウンセラアクセス権の授受により他人のデータのアクセス許可を得る仕組みオプトインメッセージ図8 次世代のがんゲノムデータシェアリングの仕組み3.むすびこれまで述べたようにがんゲノム医療は初歩的な段階を脱して、臨床現場で実用される時代になった。今後の展開に関して冒頭で述べたThe New England Journal ofMedicine 風にまとめると「図9 がんゲノム医療における始まりの終わりの始まり」となる。8 MSS 技報・Vol.30(8) Griffith,M.,et al.:CIViC is a communityknowledgebase for expert crowdsourcing theclinical interpretation of variants in cancer,Nat.Genet.,49,No.2,170 ~ 174(2017)(9) Tamborero,D.,et al.:Cancer Genome Interpreterannotates the biological and clinical relevance oftumor alterations,Genome Med.,10,25(2018)(10) 日経バイオテクONLINE:開かれたがんゲノム医療の扉、高まる期待の先にある乳癌診療とは?(2019)https://bio.nikkeibp.co.jp/atcl/column/16/072300026/091700201/(11) 林 秀幸,ほか:慶應義塾大学病院におけるがんゲノム医療,第57 回日本癌治療学会学術集会ワークショップ(2019)(12) Zehir,A.,et al.:Mutational landscape of metastaticcancer revealed from prospective clinicalsequencing of 10,000 patients,Nat. Med.,23,No.6,703 ~ 713(2017)(13) 慶應義塾大学病院:臨床研究「PleSSision–Rapid」について(2019)http://www.hosp.keio.ac.jp/st/cancer/info/20180529_1.pdf執筆者紹介谷嶋 成樹1989 年入社。関西事業部へ配属後、防衛関連システム、気象レーダシステム、電力系統制御システムのソフトウェア開発に従事。1999 年からバイオインフォマティクス・ゲノム解析のシステム開発、アルゴリズム研究業務に転向。2014 年世界初のiPS 細胞を用いた臨床研究「加齢黄斑変性に対する自己iPS 細胞由来網膜色素上皮シート移植」の共同研究グループに参画し、全ゲノムデータ解析を実施した。関西事業部バイオメディカルインフォマティクス開発部 部長。